2021─Ļ6į┬23-26╚š���Ż¼ę╗─Ļę╗Č╚Ą─╚½Ū“Ė╬┼KīW(xu©”)╩óĢ■Ī¬Ī¬ć°ļHĖ╬┼K┤¾Ģ■Ż©ILC 2021Ż®ęįŠĆ╔Žą╬╩Įš┘ķ_��ĪŻį┌┤╦┤╬┤¾Ģ■╔Ž�����Ż¼üĒūį╝¬┴ų┤¾īW(xu©”)Ą┌ę╗ßt(y©®)į║┼�Ż┐ĪŲµĮ╠╩┌łFĻĀĄ─╚A╚▓®╩┐ī”ę╗ĒŚįuārŖW┴ū▓╝ĒfŲ¼┬ō(li©ón)║Ž¹}╦ß▀_└Ł╦¹ĒfŲ¼ų╬»¤┬²ąį▒¹ą═Ė╬čū│╔╚╦╗╝š▀Ą─»¤ą¦║═░▓╚½ąįĄ─ķ_Ę┼ąįĪóČÓųąą─IIIŲ┌┼R┤▓蹊┐ĮY(ji©”)╣¹▀Mąą┴╦ĮķĮB���ĪŻ┤╦┤╬╣½▓╝Ą─IIIŲ┌┼R┤▓蹊┐ĮY(ji©”)╣¹�Ż¼īó×ķŖW┴ū▓╝ĒfŲ¼į┌Ę║╗∙ę“ą═┬²ąį▒¹ą═Ė╬čū╗╝š▀ųąĄ─æ¬(y©®ng)ė├╠ß╣®ėą┴”ūCō■(j©┤)����ĪŻ

ŖW┴ū▓╝ĒfŲ¼Ż©į°ė├├¹Ż║║═śĘ▓╝ĒfŲ¼Ż¼SH229Ų¼Ż®╩Ūė╔─ŽŠ®╩ź║═╦ÄśI(y©©)╣╔Ę▌ėąŽ▐╣½╦Šūįų„čą░l(f©Ī)Ą─ć°ā╚(n©©i)╩ūéĆHCV NS5BŠ█║Ž├ĖęųųŲä®�Ż¼ę▓╩Ū╚½Ū“ĘČć·ā╚(n©©i)│²╦„┴ū▓╝Ēf═ŌĄ┌Č■éĆ═Ļ│╔IIIŲ┌┼R┤▓蹊┐▓ó╠ßĮ╗╔Ž╩ą╔ĻšłĄ─HCV NS5BęųųŲä®ĪŻū„×ķę╗┐Ņ║╦▄šŅÉŪ░¾w╦Ä╬’����Ż¼ŖW┴ū▓╝Ēf┐╔═©▀^Ė╬┼K┤·ųxŻ¼▐D(zhu©Żn)╗»×ķŠ▀ėą┐╣▓ĪČŠ╗ŅąįĄ─ĘŪ╠ņ╚╗║╦▄š╚²┴ū╦ß����ĪŻįōĘŪ╠ņ╚╗║╦▄š╚²┴ū╦ß┐╔ęį┼c▒¹Ė╬▓ĪČŠÅ═(f©┤)ųŲ╦∙ąĶĄ─NS5BŠ█║Ž├Ė░l(f©Ī)╔·ĖéĀÄąįĮY(ji©”)║Ž��Ż¼Ī░╝┘░ńĪ▒│╔▓ĪČŠÅ═(f©┤)ųŲĢrąĶꬥ─╠ņ╚╗║╦▄š╚²┴ū╦ßōĮ╚ļĄĮHCV RNAµ£ųą�����Ż¼ą╬│╔Õeš`Ą─▓ĪČŠRNA─Ż░Õ�����Ż¼ī¦(d©Żo)ų┬▓ĪČŠRNAµ£Ą─čėķL╠ßŪ░ĮKų╣�Ż¼▒¹Ė╬▓ĪČŠĄ─Å═(f©┤)ųŲę▓ę“┤╦▒╗ĮKų╣���ĪŻ┼R┤▓Ū░蹊┐ĮY(ji©”)╣¹▒Ē├„�Ż¼į┌¾w═ŌÅ═(f©┤)ųŲūė╗“HCVccŽĄĮy(t©»ng)ųą����Ż¼ŖW┴ū▓╝Ēfī”Ė„╗∙ę“ą═HCVĄ─ęųųŲ╗ŅąįŠ∙ā×(y©Łu)ė┌╦„┴ū▓╝ĒfŻ¼ŪęŖW┴ū▓╝Ēf┼cNS5AęųųŲ䮹}╦ß▀_└Ł╦¹Ēfļp╦Ä┬ō(li©ón)║Ž║¾│╩¼F(xi©żn)ųąČ╚ų┴Ė▀Č╚Ą─ģf(xi©”)═¼ū„ė├���ĪŻ

▒Š┤╬╣½▓╝Ą─┼R┤▓蹊┐╩Ūę╗ĒŚķ_Ę┼ąį����ĪóČÓųąą─IIIŲ┌┼R┤▓蹊┐���Ż¼ų╝į┌┤_ūCŖW┴ū▓╝ĒfŲ¼┬ō(li©ón)║Ž¹}╦ß▀_└Ł╦¹ĒfŲ¼ų╬»¤12ų▄ī”╗∙ę“1���Īó2Īó3║═6ą═┬²ąį▒¹ą═Ė╬čū│╔╚╦╗╝š▀Ą─»¤ą¦║═░▓╚½ąį��ĪŻįć“×▓╔ė├å╬ĮM─┐ś╦ųĄĘ©įO(sh©©)ėŗ����Ż¼╦∙ėą╩▄įćš▀Š∙Įė╩▄×ķŲ┌12ų▄Ą─ŖW┴ū▓╝ĒfŲ¼600 mg QD┬ō(li©ón)║Ž¹}╦ß▀_└Ł╦¹ĒfŲ¼60 mg QDų╬»¤ĪŻ═Ļ│╔ų╬»¤Ą─╩▄įćš▀į┌ų╬»¤ĮY(ji©”)╩°║¾Ą┌4ų▄║═Ą┌12ų▄Įė╩▄ļSįL�ĪŻį┌ų╬»¤ĮY(ji©”)╩°║¾Ą┌12ų▄ļSįLĢrHCV RNA < LLOQĄ─╩▄įćš▀Ż¼į┌ų╬»¤ĮY(ji©”)╩°║¾Ą┌24ų▄▀MąąŅ~═ŌļSįL��ĪŻčąŠ┐Ą─ų„ę¬ėąą¦ąįĮK³c×ķSVR12┬╩����Ż¼┤╬ę¬ėąą¦ąįĮK³c░³└©SVR4┬╩ĪóSVR24┬╩Ą╚����ĪŻ
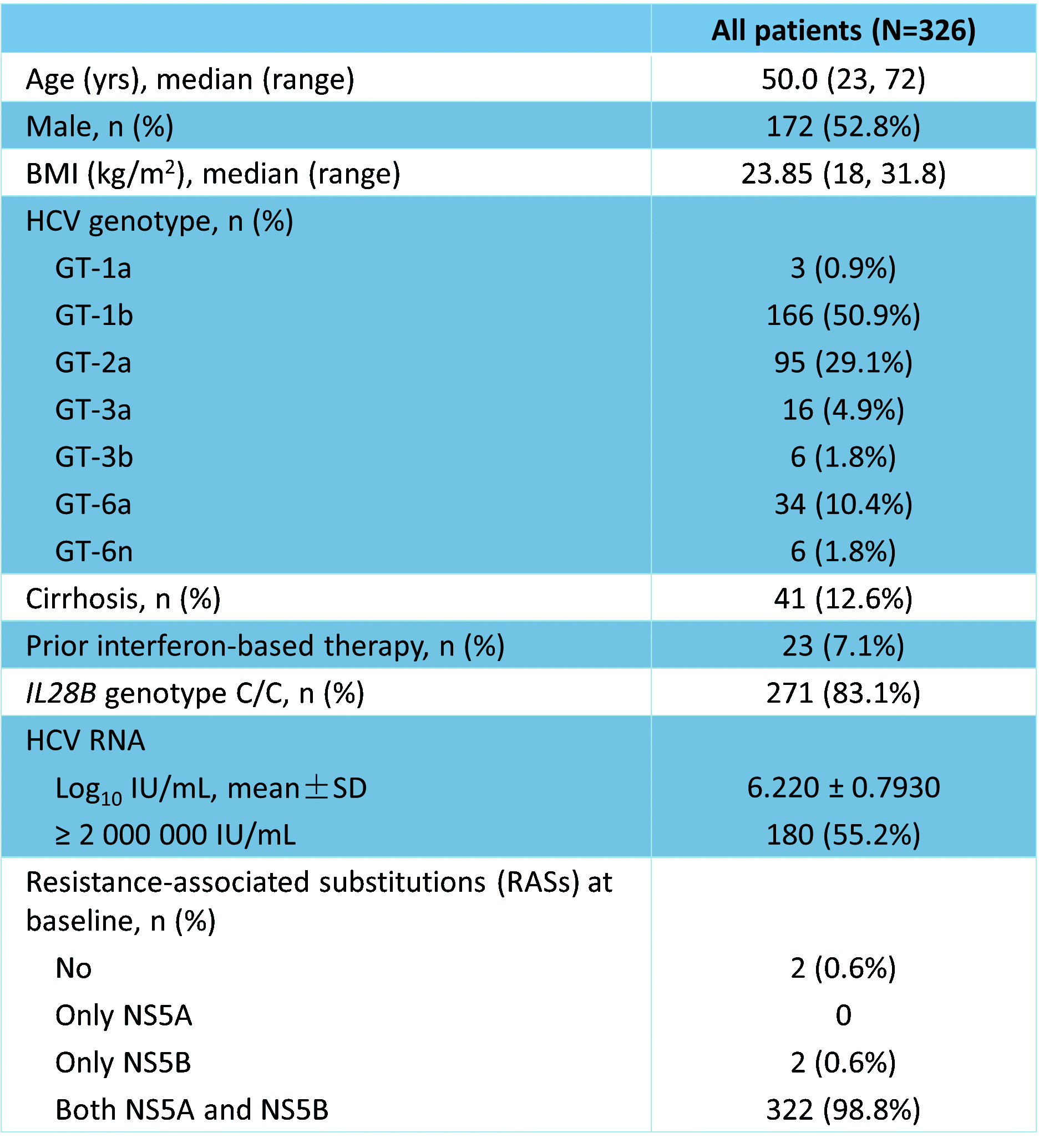
▒ŠčąŠ┐╣▓326└²╩▄įćš▀Įė╩▄┴╦įć“×╦Ä╬’Įo╦ÄŻ¼ŲõųąGT-1a 3└²Ż©0.9%Ż®�����ĪóGT-1b 166└²Ż©50.9%Ż®ĪóGT-2a 95└²Ż©29.1%Ż®����ĪóGT-3a 16└²Ż©4.9%Ż®ĪóGT-3b 6└²Ż©1.8%Ż®��ĪóGT-6a 34└²Ż©10.4%Ż®��ĪóGT-6n 6└²Ż©1.8%Ż®�����Ż╗į┌╦∙ėą╩▄įćš▀ųą�����Ż¼╣▓ėą41└²Ż©12.6%Ż®║Ž▓óėą┤·āöąįĖ╬ė▓╗»��Ż¼23└²Ż©7.1%Ż®╝╚═∙Įė╩▄▀^Ė╔ö_╦žĘĮ░Ėų╬»¤�Ż¼Ūę99.4%Ą─╩▄įćš▀┤µį┌NS5A║═/╗“NS5BŽÓĻP(gu©Īn)╬╗³c╗∙ŠĆ─═╦Ä═╗ūāĪŻ╦∙ėą╩▄įćš▀Ą─HCV RNAŲĮŠ∙╗∙ŠĆ╦«ŲĮ┤¾ė┌6 Log10 IU/mL���ĪŻ
įć“×ĮY(ji©”)╣¹’@╩Š��Ż¼į┌ų╬»¤ĮY(ji©”)╩°║¾Ą┌12ų▄Ģr���Ż¼╣▓ėą321└²╩▄įćš▀½@Ą├┴╦│ų└m(x©┤)▓ĪČŠīW(xu©”)æ¬(y©®ng)┤��Ż¼SVR12┬╩╝░95%ų├ą┼ģ^(q©▒)ķg×ķ98.5%Ż©96.5%,99.5%Ż®Ż¼»¤ą¦’@ų°ā×(y©Łu)ė┌Üv╩Ęī”šš88%Ż©P<0.0001Ż®�ĪŻį┌½@Ą├SVR12Ą─321└²╩▄įćš▀ųąŻ¼│²1└²╩▄įćš▀į┌ų╬»¤ĮY(ji©”)╩°Ą┌24ų▄╩¦įL═Ō�Ż¼ŲõėÓ╩▄įćš▀į┌ų╬»¤ĮY(ji©”)╩°Ą┌24ų▄Š∙└^└m(x©┤)½@Ą├┴╦│ų└m(x©┤)▓ĪČŠīW(xu©”)æ¬(y©®ng)┤ĪŻ
üåĮMĘų╬÷ĮY(ji©”)╣¹’@╩Š���Ż¼ŖW┴ū▓╝Ēf┬ō(li©ón)║Ž¹}╦ß▀_└Ł╦¹ĒfĄ─ų╬»¤ĘĮ░Ėį┌▓╗═¼╗∙ę“ą═Ą─HCV╗╝š▀ųąŠ∙▒Ē¼F(xi©żn)│÷┴╝║├Ą─ų╬»¤ą¦╣¹���Ż¼Ųõųąį┌GT-1aĪóGT-2a�����ĪóGT-3b╗╝š▀ųąĄ─SVR12┬╩Š∙▀_ĄĮ┴╦100%���Ż╗į┌GT-1b����ĪóGT-3aĪóGT-6╗╝š▀ųąĄ─SVR12┬╩ę▓Ęųäe▀_ĄĮ┴╦98.8%��Īó93.8%║═95%�ĪŻ╠žäeųĄĄ├ūóęŌĄ─╩ŪŻ¼ī”ė┌─┐Ū░ūŅļyų╬Ą─GT-3╗╝š▀Ż©╠žäe╩ŪGT3b╗╝š▀Ż®����Ż¼ŖW┴ū▓╝Ēf┬ō(li©ón)║Ž¹}╦ß▀_└Ł╦¹ĒfĄ─ų╬»¤ĘĮ░Ė▒Ē¼F(xi©żn)│÷┴╦Ė³Ė▀Ą─│ų└m(x©┤)▓ĪČŠīW(xu©”)æ¬(y©®ng)┤┬╩ĪŻę“┤╦�Ż¼┼c¼F(xi©żn)ėąų╬»¤╩ųČ╬ŽÓ▒╚Ż¼ŖW┴ū▓╝Ēf┼c¹}╦ß▀_└Ł╦¹ĒfĄ─┬ō(li©ón)║Žų╬»¤ĘĮ░ĖŠ▀ėąĖ³ā×(y©Łu)ąŃĄ─ų╬»¤ą¦╣¹���ĪŻ

į┌░▓╚½ąįĘĮ├µ��Ż¼▒ŠčąŠ┐Ų┌ķg╬┤░l(f©Ī)╔·╩▄įćš▀╦└═÷╩┬╝■�Ż¼āH░l(f©Ī)╔·1└²ī¦(d©Żo)ų┬╩▄įćš▀╠ßŪ░═╦│÷Ą─▓╗┴╝╩┬╝■�����ĪŻį┌ų╬»¤║¾│÷¼F(xi©żn)Ą─▓╗┴╝╩┬╝■Ż©TEAEŻ®ųą�Ż¼Į^┤¾ČÓöĄ(sh©┤)×ķ▌pČ╚╗“ųąČ╚Ż¼āHėą14└²Ż©4.3%Ż®╩▄įćš▀░l(f©Ī)╔·┴╦3╝ē╝░ęį╔ŽĄ─īŹ“×╩ęÖz▓ķ«É│Ż���Ż¼░³└©Ė╩ė═╚²§ź╔²Ė▀�����Īóč¬╝Ī╦ß┴ū╦ß╝ż├Ė╔²Ė▀���Īóč¬Ō}ĮĄĄ═�����Īóč¬ŌøĮĄĄ═���Īó謹Ī░ÕėŗöĄ(sh©┤)ĮĄĄ═���ĪŻįć“×ųą╬┤│÷¼F(xi©żn)╚╬║╬3╝ē╝░ęį╔ŽĄ─Ė╬╣”─▄Ż©ALT�ĪóAST����Īó─æ╝t╦žŻ®«É│ŻŪķørĪŻįō蹊┐ĮY(ji©”)╣¹▒Ē├„�����Ż¼ŖW┴ū▓╝Ēf┬ō(li©ón)║Ž¹}╦ß▀_└Ł╦¹ĒfĄ─ų╬»¤ĘĮ░ĖŠ▀ėą▌^║├Ą─░▓╚½ąį��ĪŻ
┐éų«Ż¼┤╦┤╬ŖW┴ū▓╝ĒfIIIŲ┌┼R┤▓蹊┐öĄ(sh©┤)ō■(j©┤)Ą─╣½▓╝���Ż¼╩Ū╬ęć°▒¹ą═Ė╬čūų╬»¤ŅI(l©½ng)ė“Ą─ųž┤¾═╗ŲŲ���Ż¼×ķųąć°įŁäō(chu©żng)▒¹Ė╬DAA╦Ä╬’į┌Ę║╗∙ę“ą═┬²ąį▒¹ą═Ė╬čūų╬»¤ŅI(l©½ng)ė“╠ß╣®┴╦ėą┴”ūCō■(j©┤)Ż¼Å─Č°Įo╬ęć°Ą─┬²ąį▒¹Ė╬╗╝š▀╠ß╣®┴╦Ė³ā×(y©Łu)Ą─ų╬»¤▀xō±����ĪŻ
ĻP(gu©Īn)ė┌╩ź║═╦ÄśI(y©©)
╩ź║═╦ÄśI(y©©)│╔┴óė┌1996─ĻŻ¼╩Ūę╗╝ę╝»ą┬╦Äčą░l(f©Ī)�����Īó╦ÄŲĘ╔·«a(ch©Żn)║═ūįų„īW(xu©”)ąg(sh©┤)═ŲÅVė┌ę╗¾wĄ─ć°╝ęųž³cĖ▀ą┬╝╝ąg(sh©┤)Ų¾śI(y©©)���ĪŻ╣½╦ŠÅ─ą┬╦Äčą░l(f©Ī)Ų▓Į���Ż¼ķLŲ┌łį│ųīŹ╩®«a(ch©Żn)ŲĘčą░l(f©Ī)äō(chu©żng)ą┬æ(zh©żn)┬įŻ¼ų°┴”čą░l(f©Ī)š¹¾w╔·æB(t©żi)ŽĄĮy(t©»ng)Į©įO(sh©©)���Ż¼īŹ¼F(xi©żn)╗Ņąį╬’┘|(zh©¼)░l(f©Ī)¼F(xi©żn)�����Īó╔·╬’║Y▀x�����Īó╗∙ĄA(ch©│)┼R┤▓ŅA(y©┤)īŹ“ץ╚ŽÓ╗źŲź┼õ����Ż¼ų┬┴”ė┌│╔×ķ┐╣─[┴÷Īó┐╣Ėą╚ŠŽĄĮy(t©»ng)╝▓▓ĪŅI(l©½ng)ė“Ą─ŅI(l©½ng)Ž╚š▀�����ĪŻ╩ź║═╦ÄśI(y©©)¼F(xi©żn)ōĒėąę╗Śl░³└©30ėÓéĆį┌čąą┬╦ÄŲĘĘNĄ─«a(ch©Żn)ŲĘ╣▄ŠĆ��Ż¼Ųõųą7éĆį┌čąą┬╦Äš²į┌▀Mąą┼R┤▓įć“×���ĪŻ╬┤üĒŻ¼╩ź║═╦ÄśI(y©©)īó│ų└m(x©┤)▒Ż│ųš╝õN╩█╩š╚ļ20%Ą─čą░l(f©Ī)═Č╚ļ┴”Č╚����Ż¼ų°┴”ė┌ØMūŃ╗╝š▀Ą─┼R┤▓ąĶŪ¾Ż¼ūīĖ³ČÓ╗╝š▀╩▄ęµ�����ĪŻ
Ż©ūóŻ║╩źųZĄŽ?Sanoldi?ŖW┴ū▓╝ĒfŲ¼ ░l(f©Ī)├„īŻ└¹ īŻ└¹╠¢ ZL201410081865.5Ż®